DERS 6: HİDROJEN
ATOMU




Dersin Konuları
-
Hidrojen atomunun tayfı
-
Hidrojenin 21-cm Salması
-
Atomların İyonizasyonu
-
Astronomide bu salma ve soğurmaların nasıl kullanılıyor.
-
Her element, iyon, yada molekülün kendine özgü imzası vardır
-
Bu imzalar Astronominin temel taşıdır.
Hidrojen atomunun tayfı
-
Hidrojen atomunun bir tane elektronu vardır, böylece tayf açısından en
basit yapıya sahip element özelliğini taşımaktadır.
-
Diğer elementler gibi Hidrojen'inde kesikli salma yada sağurma çizgileri
vardır ki bu çizgiler elektronun bir enerji seviyesinden başka bir enerji
seviyesine geçişlerde ortaya çıkar.
-
Bir enerji düzeyi "yukarıya" elektronun çıkması için bir fotonun doğru
bir enerjiye (yada dalgaboyuna) sahip olması gerektiğini unutmamak gerekir.
-
Hidrojen atomu moröte, görünür, kırmızıöte ve radyo bölgede kesikli dalgaboylarında
enerji soğurabilir ve salabilir.
-
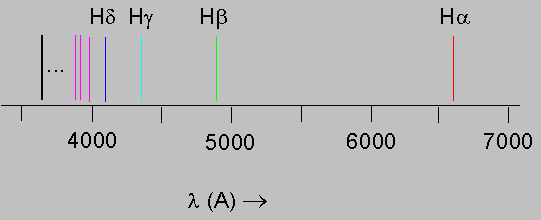
Görünür bölgede olanlarına Balmer çizgileri adı verilmektedir.
Hydrogen Balmer Spectrum

Enerji
-
Atom dünyasındaki enerjiler genellikle elektron volt (eV) biriminde ifade
edilir.
-
Örneğin Hidrojen atomu için n=2 ile n=1 enerji seviyeleri arasınaki farkı
10.2eV'dur.
-
E = hc/lamda olduğundan lamda = 1216 A olur.
Hidrojen Atomunun Tayfsal Çizgileri
-
Lyman Çizgileri - Morötesi (Ultraviole)
-
Ly-alfa: n=2 ==> 1, lamda = 1216 A
-
Ly-beta: n=3 ==> 1, lamda = 1026 A
-
Ly-gama: n=4 ==> 1, lamda = 973 A
-
Balmer Çizgileri - Görünür Bölge
-
H-alfa: n=3 ==> 2, lamda = 6563 A
-
H-beta: n=4 ==> 2, lamda = 4861 A
-
H-gama: n=5 ==> 2, lamda = 4341 A
H Tayfsal Çizgileri hakkında Notlar
-
Kuantum sayısı büyüdükçe enerji düzeyleri birbirine yaklaşmaktadır.
-
Kuantum sayıları arasındaki büyük farklılıklar büyük enerjilerin soğurulması
yada salınması anlamına gelir.
"Süreklilik"
-
Süreklilikteki bir elektron protondan kaçabilir.
-
Süreklilikteki bir elektron quantize olmamiştir.
-

Hidrojen'in 21-cm Işınımı
-
Astronomide önemli bir tayf çizgisi olan Hidrojen'in 21-cm çizgisi yıldızlararası
gazın ölçülmesinde kullanılır.
-
Bu tayfın radyo bölgesine ait değildir.
-
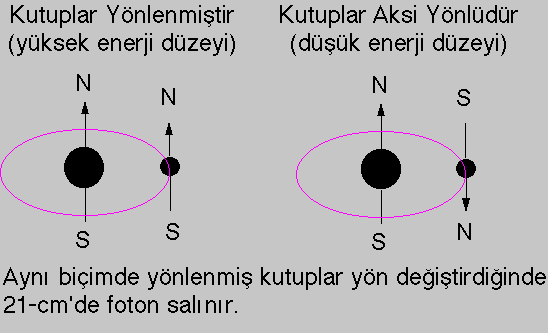
n=1 seviyesinde (temel seviye) bulunan H atomu aslında iki küçük enerji
seviyesine ayrılır.
-
Bu enerji ayrimi elektronun ve protonun kendine özgü dönme eksenini olmasından
kaynaklanır, küçük mıknatıslar biçiminde davranışlar gösterir.
-
Kuzey kutup ile enerji aynı yönlenmeye sahip ise bu yönde olmama halinden
daha fazla enerjiye sahiptir.
-
Küçük sayıda H-atomlarının salmaları zayiftir fakat Hidrojenin uzayda çok
bol bulunmasi bu zayıf enerjinin ölçülebilmesini sağlamaktadır.
-
Kendi galaksimizde bu tür ışınımların oldukça bol olduğunu görebilmekteyiz.
. 
İyonizasyon ve İyonlar
-
Eğer foton yeterince enerjiye sahip ise bir atomu iyonize edebilir.
-
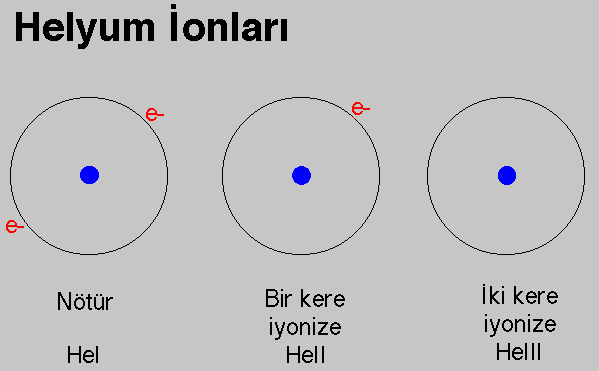
Bir atom iyon haline bir yada daha fazla elektronunu kaybettiğinde ulaşır.
-
Çok ender ve az rastlanmasına rağmen ayrıca ilave bir elektrona sahip olabilen
atomlarda iyon durumuna geçer.
Hidrojenin İyonlaşması
-
Hidrojen atomunun iyonlaşma enerjisi 13.6 eV dur.
-
Temel seviyeden (n=1) bir elektronun iyonlaşması için fotonun enerjisi
13.6 eV veya daha büyük olmalıdır.
-
İyonize olmuş bir hidrojen atomu kendi başına bir protontan oluşur.
Gösterim
|
Kısaltma
|
Anlam
|
Örnekler
|
|
I
|
nötr
|
He I, O I
|
|
II
|
1 kere iyonize olmuş
|
He II, O II
|
|
III
|
2 kere iyonize olmuş
|
He III, O III
|
-
Astronomlar yukarıdaki gösterimleri bir atomun iyonize durumunu göstermek
amacıyla kullanırlar.
-
It takes progressively more energy to remove successive electrons from
an atom.
-
Bunun anlamı He II'nin He I'den daha zor iyonize yapılabileceğidir.
-
Not: He IV'i oluşturamazsınız.
Tayf Çizgileri: Astronominin Temel Taşı
-
Bir iyon tarafından oluşturulan tayf çizgileri seti her yerde aynıdır ve
astronomi açısından temel öneme sahiptir.
-
Astronomlar bunlara bir iyonun "parmak izleri" şeklinde bakarlar.
-
Galaksi ve evren boyunca elementlerin belirlenebilmesini sağlarlar.
-
Bu parmak izlerine bakarak oksijen, karbon, demir, vb. elementleri tesbit
edebiliyoruz.
-
Bu parmak izlerine ilaveten:
-
Yıldızların kimyasal bileşimlerini
-
Elementlerin bolluklarını
-
Gazların fiziksel durumlarını
-
Yoğunluklarını ve sıcaklıklarını
belirleyebiliyoruz.
Katı cisimlerin salmaları
-
Katı cisimler kesiklilikten çok sürekli tayf verirler.
-
Bu durum atomlar için farklıdır.
-
Örneğin:
-
Tungsten filamalı lamba - süreklilik gösterirken
-
Fluorasan lambası - kesikli spektrum verir.









